諾和諾德首款口服減肥藥FDA獲批!禮來霸主地位還能穩多久?
美國FDA批准諾和諾德Wegovy注射劑的口服片劑版本,成為全球首款獲批的GLP-1類口服減肥藥,搶佔市場先機。此舉為近期股價下跌、面臨禮來挑戰的諾和諾德注入強心針,盤前股價應聲上漲。口服劑型預計能吸引對注射有顧慮或認為病情未嚴重到需注射的患者,提升用藥意願與使用率。Oasis 4試驗結果顯示,25毫克口服劑量在64週後平均減重16.6%。多數醫生傾向於優先開立口服Wegovy。公司預計一月初在美國上市,並已備妥充足供應。

TradingKey - 在與禮來公司的減肥藥霸權爭奪戰中,諾和諾德終於迎來戰略轉折點!
12月22日週一,美國食品藥品監督管理局(FDA)正式批准諾和諾德Wegovy注射劑的口服片劑版本,使其成為全球首款獲批的GLP-1類口服減肥藥。
這一突破不僅讓諾和諾德搶在禮來口服減肥藥奧福格列隆(orforglipron)獲批之前佔據市場先機,更在其經歷股價腰斬、市場份額流失、盈利預警的至暗時刻,為公司注入一劑強心針。
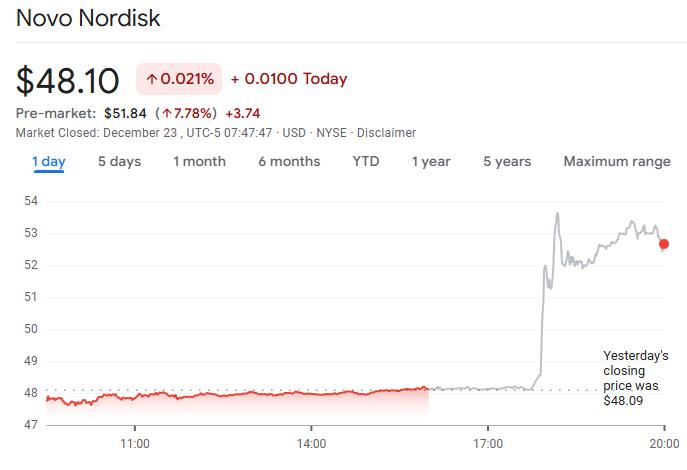
獲批消息公佈後,諾和諾德在美國上市的股票在盤前交易中上漲超7%。
重振市場份額的關鍵一役
美國公共衛生數據顯示,全國約四成成年人面臨肥胖困擾,而KFF最新民調揭示,當前約12%的成年人正在使用GLP-1類藥物進行體重管理或慢性病治療。這一龐大的患者群體,構成了製藥巨頭競相爭奪的核心戰場。
對諾和諾德而言,2025年是充滿挑戰的一年,該公司的股價今年已累計下跌超過44%。
儘管其在注射型減肥藥領域曾擁有先發優勢,卻因難以應對需求的爆炸式增長,導致市場份額被競爭對手蠶食。禮來公司憑藉其注射劑Zepbound迅速反超,該產品不僅在療效上被證明優於諾和諾德的Wegovy,更在美國每週處方量排行榜上佔據領先地位。
在這一背景下,FDA對口服Wegovy的批准顯得尤為關鍵。BMO Capital Markets分析師Evan Seigerman在報告中指出:"諾和諾德的GLP-1減肥藥片獲得批准,對於該公司而言,在最近面臨維持腸促胰素市場份額主導地位的挑戰之際,這無疑是一次急需的勝利。"
諾和諾德正寄希望於這款口服藥丸的先發優勢來重振其在美國市場的銷售表現。禮來的下一代口服減肥藥福格列隆最早可能在3月底獲得批准,該時間窗口對諾和諾德至關重要。
諾和諾德美國營運執行副總裁David Moore表示,每日服用的藥丸可能會提高人們對該藥物的興趣和使用率。他透露,公司正在美國北卡羅來納州生產這款藥丸,並且"一段時間以來"一直在儲備該藥丸的供應,以確保"充足的供應"。
面對全球醫療體系因肥胖問題而承受的日益增長的經濟負擔,這種口服療法有望覆蓋更廣泛的治療需求,為數千萬尚未得到有效干預的患者提供新方案,預計將在2030年代推動全球減肥藥市場規模達到每年1500億美元的水平。
從注射到口服的跨越
一些健康專家表示,口服劑型的問世將為兩類特定人群帶來福音:一類是對注射存在心理抵觸的患者,另一類則是那些認為自身狀況尚未嚴重到需要接受注射治療的潛在獲益者。
遠程醫療公司Ro的執行長Zachariah Reitano稱:“有些人害怕打針,有些人會出現‘注射疲勞’,還有些人覺得自己病情不嚴重,認為注射治療過於激進,對他們而言,口服藥物無疑是更便捷的選擇。”
諾和諾德公司表示,口服藥片含有25毫克司美格魯肽,與注射用Wegovy和Ozempic的活性成分完全一致,將繼續以“Wegovy”為品牌名稱進行銷售,並計畫於1月初在美國開始銷售這款新藥片。
Oasis 4三期臨床試驗的結果為該藥物的臨床價值提供了堅實依據。數據表明,每日服用25毫克劑量的患者,在64週的治療週期後,平均體重降低了約16.6%,減重效果顯著。
醫療從業者的接受度調查顯示,醫生群體對口服劑型展現出高度認可。FirstWord近期針對美國和歐洲內分泌科及全科醫生的調研發現,85%的受訪者表示至少會在某種程度上優先選擇開具口服Wegovy而非注射劑。
諾和諾德美國營運執行副總裁Dave Moore在獲批前表示:"我們透過多年的研究發現,口服藥物的出現確實能夠吸引、激活並激勵不同人群尋求治療。他們可以與醫生討論這種藥物是否適合自己。"
"我們感到興奮的是,能夠為人們提供另一種選擇,並確保他們能夠像使用注射劑一樣便捷地獲得治療,"他繼續說道。
本內容經由 AI 翻譯並經人工審閱,僅供參考與一般資訊用途,不構成投資建議。